Председатель: академик РАН Е.Л. Насонов.
Секретарь: д.м.н. В.Н. Амирджанова.
На заседании присутствовало 86 человек, из них 59 членов Экспертного совета.
Повестка:
1. О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2015 г. и на плановый период 2016–2017 гг., согласно Постановлению Правительства Российской Федерации от 28.11.2014 г. № 1273. К.м.н. Т.М. Новоселова, Е.А. Бардина.
2. Обсуждение клинических рекомендаций Общероссийской общественной организации «Ассоциация ревматологов России» (АРР) по безопасности применения лекарственных препаратов при лечении ревматоидного артрита (РА). Академик РАН Е.Л. Насонов, проф. Ю.В. Муравьев, д.м.н. Д.Е. Каратеев.
3. Обсуждение проекта клинических рекомендаций АРР по лечению больных системной красной волчанкой (СКВ). Проф. С.К. Соловьев.
4. Утверждение разработанных клинических рекомендаций:
1) федеральные клинические рекомендации по планированию беременности и наблюдению за беременными с СКВ;
2) федеральные клинические рекомендации по скринингу и мониторингу туберкулезной инфекции у больных, получающих генно-инженерные биологические
препараты (ГИБП);
3) федеральные клинические рекомендации по лечению болезни депонирования кристаллов пирофосфата кальция;
4) федеральные клинические рекомендации по периоперационному ведению пациентов с РА, нуждающихся в эндопротезировании крупных суставов нижних конечностей;
5) федеральные клинические рекомендации по диагностике и лечению психических расстройств при ревматических заболеваниях (РЗ);
6) федеральные клинические рекомендации и стандарты оказания помощи пациентам с псориатическим артритом (ПсА).
5. Организационные вопросы взаимодействия между пациентскими организациями и научным ревматологическим сообществом. Межрегиональная общественная благотворительная организация инвалидов «Общество взаимопомощи при болезни Бехтерева» (Г.С. Бостынец), Российская ассоциация больных ревматическими заболеваниями «Надежда» (Н.А. Булгакова).
1. По первому вопросу выступила главный врач ФГБНУ «НИИР им. В.А. Насоновой» к.м.н. Т.М. Новоселова. В своем выступлении она представила положения, входящие в Программу государственных гарантий бесплатного оказания гражданам медицинской помощи на 2015 г. и на плановый период 2016–2017 гг., согласно Постановлению Правительства Российской Федерации от 28.11.2014 г. №1273:
I. Общие положения.
II. Перечень видов, форм и условий медицинской помощи, оказание которойосуществляется бесплатно.
III. Перечень заболеваний и состояний, оказание медицинской помощи при которых осуществляется бесплатно, и категории граждан, оказание медицинской помощи которым осуществляется бесплатно.
IV. Базовая программа обязательного медицинского страхования.
V. Финансовое обеспечение Программы.
VI. Средние нормативы объема медицинской помощи.
VII. Средние нормативы финансовых затрат на единицу объема медицинской помощи, средние подушевые нормативы финансирования.
VIII. Требования к территориальной программе в части определения порядка, условий предоставления медицинской помощи, критериев доступности и качества медицинской помощи.
IX. Критерии доступности и качества медицинской помощи.
Подробно представлен Перечень видов высокотехнологичной медицинской помощи в ревматологии, педиатрии и травматологии и ортопедии, включенных в базовую программу обязательного медицинского страхования, финансовое обеспечение которых осуществляется за счет субвенции из бюджета Федерального фонда обязательного медицинского страхования бюджетам территориальных фондов обязательного медицинского страхования. Представлен план работы ФГБНУ «НИИР им. В.А. Насоновой» на 2015 г.
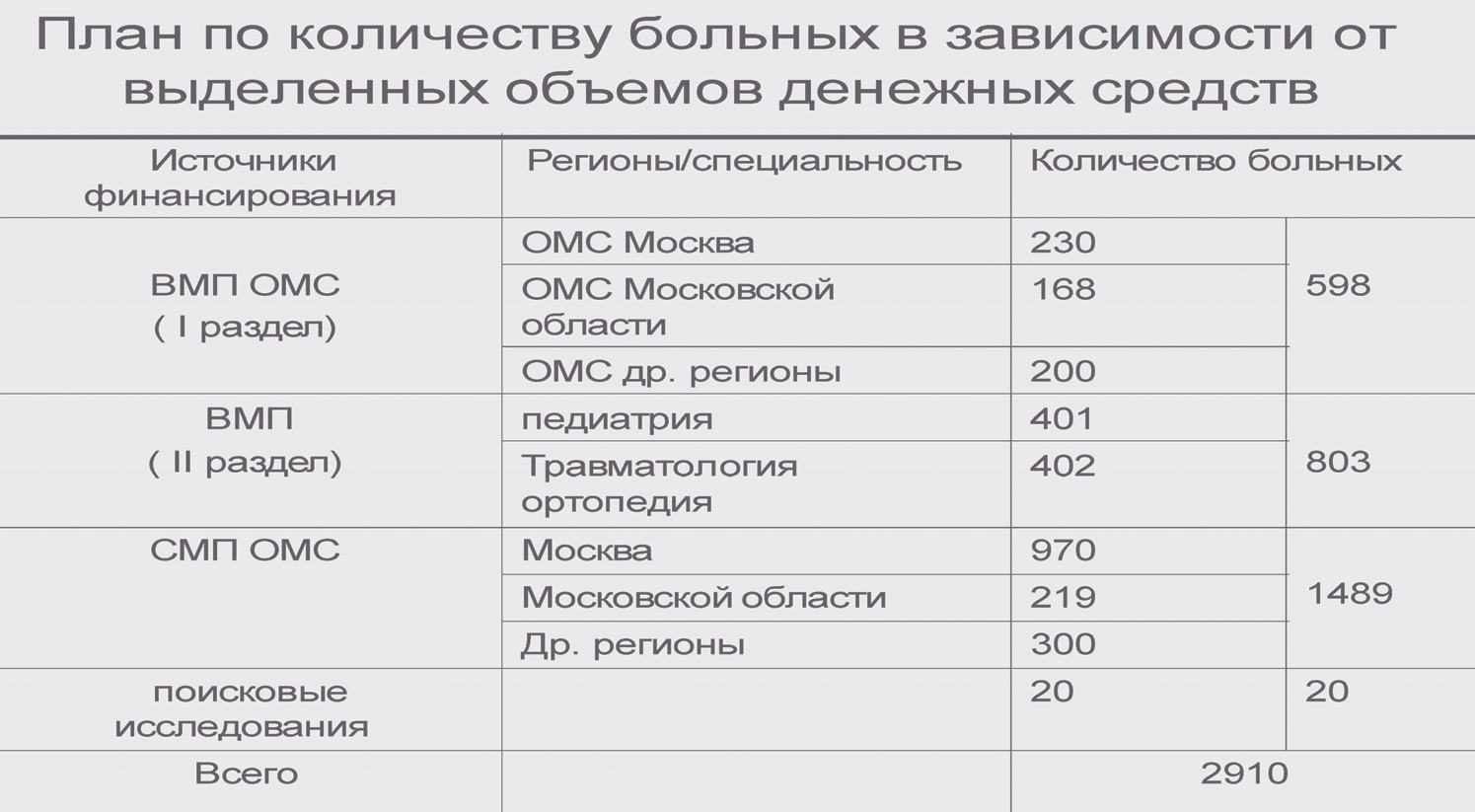
В докладе отмечено, что ФГБНУ «НИИР им. В.А. Насоновой» в течение 57 лет возглавляет ревматологическую службу в стране, в рамках модернизации за последние 3 года институт был оснащен на уровне международных стандартов, поэтому в настоящее время в институте имеются все возможности для увеличения потока пациентов с наиболее сложными формами РЗ из регионов Российской Федерации.
2. Обсуждены клинические рекомендации АРР по безопасности применения лекарственных препаратов при лечении РА. Выступил проф. Ю.В.Муравьев. Проведено интерактивное голосование (в скобках указан уровень доказательности).
Результаты голосования:
1. Периоперативное лечение метотрексатом (МТ) может быть безопасно продолжено у больных РА, подвергшихся избирательной ортопедической операции (А), – 72,8%.
2. ГИБП следует отменить до хирургического вмешательства (с учетом индивидуальных особенностей больного, характера операции и фармакокинетики препарата). Применение ГИБП после операции можно возобновить при отсутствии данных об инфекции и при удовлетворительном заживлении раны (С) – 100%.
3. До начала лечения ГИБП, ингибиторами фактора некроза опухоли α (ФНОα), абатацептом (АБЦ) и тоцилизумабом (ТЦЗ) следует проводить скрининг на латентную туберкулезную инфекцию (ЛТБИ) – потенциальный риск реактивации туберкулеза, включающий анамнез, эпидемиологические факторы риска, врачебный осмотр, туберкулиновую кожную пробу (Манту), рентгенографию грудной клетки (В) – 100%.
4. Квантифероновый тест может быть применен для идентификации ложноположительной пробы Манту у БЦЖ-вакцинированных больных и при отсутствии эпидемиологических факторов риска (D) – 100%.
5. Любой больной с ЛТБИ должен быть обсужден в плане профилактического туберкулостатического лечения (В) – 100%.
6. Лечение ГИБП следует начинать через 1–2 мес после начала туберкулостатической профилактики ЛТБИ (В) – 73%.
7. Всем больным РА рекомендуется вакцинация против гриппа и пневмококковой пневмонии до начала лечения БПВП и ГИБП. Вакцинация против гепатита В обсуждается в группах высокого риска. Вакцинация против herpes zoster назначается больным в возрасте 60 лет и старше (В) – 53,5%.
8. Инактивированные (грипп, пневмококк, гепатит В) вакцины следует применять до начала лечения МТ и/или ГИБП, поскольку эти препараты могут ослаблять иммунный ответ (В) – 22%, этот пункт рекомендовано удалить.
9. Живую вакцину следует применять по крайней мере за 2 нед до начала лечения ГИБП. Больным, уже получающим лечение, следует отменить ГИБП на соответствующий интервал времени, основанный на фармакокинетических свойствах. Вакцина herpes zoster может быть назначена больным, получающим МТ (≤25 мг/нед) и или низкие дозы глюкокортикоидов (ГК) (<20 мг/сут) (D) – 57,7%, этот пункт рекомендовано убрать.
10. В целом, больным РА с активными злокачественными новообразованиями лечение БПВП и ГИБП отменяется, пока они получают химиотерапию и радиотерапию. Решение о лечении принимается совместно с онкологом и больным (D) – 83,4%.
11. Больным РА с лимфомой в анамнезе можно применять аминохинолиновые препараты, сульфасалазин (ССЗ) и ритуксимаб (РТМ). Лечение ингибиторами ФНОα – не рекомендуется. Другие БПВП и ГИБП следует назначать с осторожностью (С) – 90,5%.
12. У больных РА с немеланомным раком кожи в анамнезе можно применять БПВП. ГИБП следует назначать с осторожностью (С) – 94,8%.
13. Больные РА, имеющие в анамнезе солидное злокачественное новообразование, могут применять БПВП, лечение ГИБП следует проводить с осторожностью (С) – 94,8%.
14. МТ в период беременности формально противопоказан. Прием препарата следует прекратить за 4 мес до возникновения беременности, и если она возникает, следует незамедлительно прервать ее (D) – 95,7%.
15. Женщины, лечившиеся лефлуномидом, должны ждать 2 года после его отмены до беременности. Женщинам, забеременевшим до истечения этих 2 лет, рекомендуется период отмывки холестирамином или активированным углем в течение 11 дней, таким образом достигается удаление препарата в течение 3 мес. После периода отмывки желательно определить в плазме уровень активного метаболита, который должен быть менее 0,02 мг/л, этот уровень должен быть подтвержден через 14 дней после первого определения (А) – 69,6%, рекомендовано убрать положение, касающееся отмывки препарата.
16. Ингибиторы ФНОα противопоказаны при беременности. Интервал между отменой препарата и оплодотворением яйцеклетки составляет для инфликсимаба (ИНФ) – 6 мес, адалимумаба (АДА) – 5 мес, относительно этанерцепта (ЭТЦ) нет рекомендаций (С). В случае беременности на фоне применения ГИБП препарат следует отменить незамедлительно (С) – 81,9%.
17. Аминохинолиновые препараты безопасны в период лактации больных РА (D). ССЗ может применяться с осторожностью в период кормления грудью. Его применение не рекомендуется, если у ребенка имеется нарушение функции почек (D). ИНФ, так же как АДА и ЭТЦ, нужно отменить за 6 мес до начала кормления грудью (В) – 93,2%, рекомендовано убрать положение об ИНФ, АДА, ЭТЦ.

3. Проведено обсуждение и интерактивное голосование по клиническим рекомендациям АРР по лечению СКВ. «Федеральные клинические рекомендации по диагностике и лечению системной красной волчанки» прошли общественную экспертизу, согласованы и утверждены 5 октября 2013 г. на заседании Пленума правления АРР, проведенного совместно с профильной комиссией Экспертного совета Минздрава России по специальности «Ревматология», и были опубликованы на сайте www.rheumatolog.ru для широкого ознакомления. Цель рекомендаций – оптимизация лечения больных СКВ с использованием стандартной терапии и инновационных ГИБП на основе современных достижений в области диагностики и фармакотерапии этого заболевания. Рекомендации АРР по лечению СКВ адаптируют современную концепцию фармакотерапии этого заболевания – «Лечение до достижения цели» («Научно-практическая ревматология», №1, 2015 г.). Согласно рекомендациям, основная стратегическая цель фармакотерапии СКВ – достижение долгосрочной выживаемости, предупреждение необратимых органных повреждений, улучшение качества жизни, связанного со здоровьем, за счет контроля активности заболевания, минимизации проявлений сопутствующих заболеваний и лекарственной токсичности. Для реализации указанной цели стандартная терапия (СТ), включающая, в том числе, противомалярийные лекарственные средства, должна назначаться всем пациентам с СКВ как можно раньше, а эффективность терапии – тщательно контролироваться и модифицироваться в зависимости от активности заболевания.
Результаты голосования по рекомендациям (приняты Экспертным советом с определенным процентом голосов):
1. Возможность определения цели терапии при СКВ – отмена глюкокортикоидов (ГК) при достижении ремиссии – 66,7%, предложено изменить формулировку: минимизация ГК, вплоть до полной отмены при достижении ремиссии.
2. Назначение циклофосфана и мофетила микофенолата для индукционной и поддерживающей терапии – 100%.
3. Определение типа волчаночного нефрита – 96,6%.
4. Лечение волчаночного нефрита в соответствии с классификационным типом нефрита – 100%.
5. Дополнительная терапия волчаночного нефрита – 96,2%.
6. Индукционная терапия волчаночного нефрита III–IV классов – 97%.
7. Особенности тактики назначения индукционной терапии – 96,2%.
8. Индукционная терапия больных с IV и V классом волчаночного нефрита с наличием полулуний – 100%.
9. Индукционная терапия больных с V классом волчаночного нефрита с наличием «мембранозного» нефрита – 100%.
10. Поддерживающая терапия больных волчаночным нефритом, у которых было достигнуто улучшение после индукционной терапии, – 100%.
11. Изменение терапии у больных волчаночным нефритом, не ответивших на индукционную терапию (при отсутствии эффекта одной или двух схем индукционной терапии с применением циклофосфана или мофетила микофенолата может быть использован РТМ) – 97,2%.
12. Лечение волчаночного нефрита при беременности – 90%.
13. Лечение поражения центральной нервной системы (ЦНС) при СКВ – 100%.
14. Применение РТМ при тяжелых формах поражения ЦНС (п. 5.2,5.3,5.4) – 95,9%.
15. Рекомендации по мониторингу активности СКВ – 92,4%.
Особое внимание членов Экспертного совета было уделено обсуждению назначения ГИБП при недостаточной эффективности СТ (сохранении активности заболевания) или плохой ее переносимости.
В 2012 г. в России был зарегистрирован первый ГИБП для лечения СКВ – белимумаб (моноклональное антитело к стимулятору B-лимфоцитов, BLyS). Лицензирование препарата стало возможным благодаря успешному проведению крупномасштабной международной программы клинических исследований BLISS (в одном из таких исследований – BLISS-52 – участие принимали четыре российских центра, в том числе ФГБНУ «НИИР им. В.А. Насоновой»), в котором участвовали свыше 1500 пациентов из различных стран мира. Препарат также был зарегистрирован FDA (США, март 2011 г.) и EMA (июль 2011 г.), и в настоящее время накоплен опыт применения более чем у 16 тыс. пациентов во всем мире. Белимумаб обладает
принципиально новым механизмом действия по сравнению с уже существующими на рынке препаратами для лечения СКВ. В отличие от последних белимумаб блокирует взаимодействие BLyS с В-лимфоцитами, в результате чего снижается скорость продукции аутоантител, играющих ключевую роль в патогенезе многих иммуновоспалительных заболеваний, включая СКВ.
Первый клинический опыт применения белимумаба в России получен в 2014 г., когда препарат начал применяться для лечения пациентов со среднетяжелыми формами СКВ. В ходе исследований белимумаба в реальной клинической практике длительностью от 1 года и более были доказаны эффективность препарата в лечении больных СКВ, а также приемлемый профиль безопасности (низкая частота развития реакций гиперчувствительности и серьезных инфекций). В исследованиях приняли участие 192 пациента в 12 российских центрах, в том числе 35 пациентов в ФГБНУ «НИИР им. В.А. Насоновой». Анализ эффективности белимумаба в российской когорте пациентов показал, что ответ по SELENA-SLEDAI был достигнут у 65,5% пациентов на 52-й неделе исследования. На основании международного и российского опыта разработаны показания к назначению белимумаба. Терапия полностью человеческим моноклональным антителом к стимулятору B-лимфоцитов (BLyS) должна назначаться всем пациентам с клинико-лабораторными признаками активности СКВ (высокая или средняя активность СКВ, т.е. >6 баллов по SELENA-SLEDAI; высокий уровень антител к дсДНК), у которых не удалось достичь ремиссии с помощью среднетерапевтических доз СТ (необходимость назначения ГК ≥7,5 мг преднизолона в сутки + гидроксихлорохин и/или ЦТ для поддержания ремиссии) в течение по крайней мере 3 мес, без признаков тяжелого активного волчаночного поражения почек и ЦНС.
Лечение белимумабом также позволило повысить качество жизни, связанное со здоровьем. По результатам объединенного анализа через 1 год лечения у пациентов с СКВ, получавших белимумаб, было показано значительно более выраженное, по сравнению с группой плацебо, улучшение индекса физического здоровья, домена жизненной активности опросника по качеству жизни SF-36 и уменьшение утомляемости по шкале FACIT-Fatigue.
Таким образом, члены Экспертного совета считают, что имеющиеся публикации по результатам клинических исследований (рандомизированные плацебоконтролируемые, когортные исследования в реальной клинической практике, собственный российский опыт) позволяют включить белимумаб в стандарты фармакотерапии СКВ в России и в список жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), что позволит повысить эффективность терапии СКВ (снижение риска тяжелых обострений заболевания; снижение дозы ГК, обладающих широким спектром негативных побочных эффектов; повышение качества жизни).
4. Единогласно утверждены следующие разработанные клинические рекомендации:
1) федеральные клинические рекомендации по планированию беременности и наблюдению за беременными с СКВ;
2) федеральные клинические рекомендации по скринингу и мониторингу туберкулезной инфекции у больных, получающих ГИБП;
3) федеральные клинические рекомендации по лечению болезни депонирования кристаллов пирофосфата кальция;
4) федеральные клинические рекомендации по периоперационному ведению пациентов с РА, нуждающихся в эндопротезировании крупных суставов нижних конечностей;
5) федеральные клинические рекомендации по диагностике и лечению психических расстройств при РЗ;
6) федеральные клинические рекомендации и стандарты оказания помощи пациентам с ПсА.
5. Обсуждены организационные вопросы взаимодействия между научным ревматологическим сообществом и пациентскими организациями: межрегиональной общественной благотворительной организацией инвалидов «Общество взаимопомощи при болезни Бехтерева» и Российской ассоциацией больных ревматическими заболеваниями «Надежда».
Профильная комиссия Экспертного совета Минздрава России по специальности «Ревматология» постановляет:
ФГБНУ «НИИР им. В.А. Насоновой»:
1. Провести работу по согласованию объемов оказания специализированной ревматологической помощи с главными внештатными специалистами-ревматологами.
2. Довести до сведения главных внештатных специалистов-ревматологов субъектов Российской Федерации и широкой медицинской общественности новые клинические рекомендации АРР по диагностике и лечению СКВ 2015 г. и обеспечить контроль за их выполнением.
3. Внести изменения в проект клинических рекомендаций по безопасности применения лекарственных препаратов при РА и завершить их подготовку к публикации в сентябре 2015 г.
4. Главным специалистам-ревматологам субъектов Российской Федерации принять во внимание Федеральные клинические рекомендации по ведению пациентов с СКВ, разработанные ведущими специалистами АРР и утвержденные Минздравом России в 2015 г.
5. Принимая во внимание опубликованные результаты международных клинических исследований белимумаба и накопленный российский опыт применения препарата в лечении СКВ, рекомендовать белимумаб для длительной терапии пациентов с СКВ при неэффективности или непереносимости предшествующей СТ.
Главным внештатным специалистам-ревматологам округов Российской Федерации:
1. Представить планы объемов оказания специализированной ревматологической помощи по регионам на 2015 г.
2. Пациентов, нуждающихся в оказании помощи в ФГБНУ «НИИР им. В.А. Насоновой», направлять через уведомления в системе мониторинга ВМП или по электронной почте в соответствии с приказом №930н от 29.12.2015 г.
Министерству здравоохранения Российской Федерации:
1. Внести изменения в Стандарт первичной медико-санитарной помощи при СКВ, утвержденный Приказом Минздрава России от 9 ноября 2012 г. №761н, и в Стандарт специализированной медицинской помощи при СКВ (в дневном стационаре), утвержденный Приказом Минздрава России от 7 ноября 2012 г. №654н, дополнив разделы перечня лекарственных препаратов, зарегистрированных на территории Российской Федерации, препаратом белимумаб.
2. Утвердить Стандарт медицинской помощи при СКВ в условиях стационара.
3. Для своевременного и адекватного обеспечения пациентов лекарственными препаратами для лечения СКВ на региональных уровнях внести изменения в Распоряжение Правительства Российской Федерации от 30 декабря 2014 г. №2782-р, дополнив перечень ЖНВЛП медицинского применения (Приложение №1) препаратом белимумаб (Бенлиста®) для лечения СКВ.
4. Утвердить клинические рекомендации, разработанные ФГБНУ «НИИР им. В.А. Насоновой» и АРР, принятые Экспертным советом Минздрава России по специальности «Ревматология»:
1) федеральные клинические рекомендации по планированию беременности и наблюдению за беременными с СКВ;
2) федеральные клинические рекомендации по скринингу и мониторингу туберкулезной инфекции у больных, получающих ГИБП;
3) федеральные клинические рекомендации по лечению болезни депонирования кристаллов пирофосфата кальция;
4) федеральные клинические рекомендации по периоперационному ведению пациентов с РА, нуждающихся в эндопротезировании крупных суставов нижних конечностей;
5) федеральные клинические рекомендации по диагностике и лечению психических расстройств при РЗ;
6) федеральные клинические рекомендации и стандарты оказания помощи пациентам с ПсА. ■
Председатель Экспертного совета Минздрава России по специальности «Ревматология»
академик РАН Е.Л. Насонов
Секретарь
д.м.н. В.Н. Амирджанова


